在中国疫情逐步得到控制之际,国外部分国家却在不断升级。疫情日益严重,人们对防护物资的需求攀升,导致价格不断上涨,尤其是硬通货“口罩”, 在有些国家居然卖到了上千元/个 。意大利口罩的在线价格从10欧分(约合人民币0.76元)长到10欧元(约合人民币76.2元),而一瓶容量一升的消毒剂上周的售价为7欧元,现在的价格为39欧元。 在韩国,KF94口罩的网上售价超过4000韩元,较疫情前的(700-800韩元)增长6-8倍 ,药店、超市等实体店的售价维持在2000韩元水平。相对于韩国、日本、意大利和伊朗来说, 西班牙的疫情没有如此严重,但口罩却十分抢手,药房里出售的FFP2型口罩单价已经达到300欧元,约合人民币2200元的天价。 目前,随着我国各地陆续复工复产、企业转产和各大医疗用品企业扩产等,我国口罩产能已得到恢复,于是近来咨询出口的企业非常多,今天我们润扬根据海关相关流程就再说说口罩如何出口?供大家参考。
首先我们必须知道您出口的口罩种类。 国内的口罩分三种:
第一种:医用口罩
作为医疗器械管理的医用口罩也分为三种:医用防护口罩、一次性普通医用口罩和医用外科口罩。 生产医用口罩,需要向省级食品药品监督管理局器械处申请办理”医疗器械产品注册证“、”医疗器械生产许可证“。而且还需要10万级以上的洁净车间,并具备微生物试验能力、环氧乙烷残留检测和相关理化试验测试能力。所谓十万级净化车间就是指空气洁净度为十万级的洁净车间。空气洁净度是指洁净环境中空气含悬浮粒子量的多少的程度,通常空气中含尘浓度高则空气洁净度低,含尘浓度低则空气洁净度高。也就是以每立方米空气中的蕞大允许粒子数来确定其空气洁净度等级。
第二种:劳保口罩
劳保口罩也叫 特种劳动防护用品 ,生产此类产品需要向省级技术监督局申请 工业品生产许可证 ,并向国家安全生产监督管理总局申请 “特种劳动防护用品安全标志”认证 ,简称为“LA”认证。
以上两种口罩申报出口时,需要提供以下资料:1. 营业执照;2. 企业生产许可证;3. 产品检验报告;4. 医疗器械注册证;5. 产品说明书、标签;6. 产品批次/号;7. 产品质量安全书;8. 产品样品图片及外包装图片
第三种:日常防护口罩
日常防护口罩相对简单,不用办理任何许可证照,将产品向有资质第三方检测机构按照相应标准送检, 取得国家权威检测报告,具备CMA、CNAS认可标识 ,即可上市销售。
我国海关对口罩出口没有限制,资质齐全的企业和合规的产品可以放心大胆地正常申报,关键是出货以前确认国外的清关要求。 根据《医疗器械监督管理条例(2017修正)》第四十四条:出口医疗器械的企业应当保证其出口的医疗器械符合进口国(地区)的要求。 口罩在不同的国家有不同准入门槛及要求,作为出口企业必须要了解:
如美国对于医用口罩的管理机构是美国食品药品监督管理局(FDA), 出口到美国的口罩若需要销售,必须要拿到美国食品药品监督管理局(FDA)认证 才可以在美国本土市场进行销售活动。在欧盟,口罩属于PPE个人防护用品,“危及健康的物质和混合物”。 根据欧盟新法规,所有出口欧盟的口罩必须获得CE认证证书。 带有CE认证标志的口罩是欧洲经济区批准的用于安全,健康和环保标准的一次性口罩。就像NIOSH根据其效率等级将呼吸器分级为N95,N99或N100一样,CE将其口罩分级为FFP1,FFP2或FFP3。
NO.1
欧盟个人防护口罩(非医疗器械)
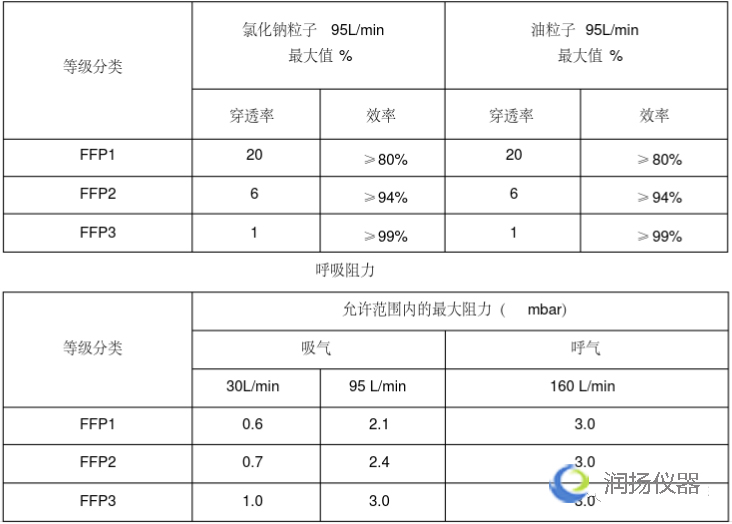
欧盟个人防护口罩的欧洲标准是EN149,按照标准将口罩分为FFP1/FFP2/FFP3三个类别,需要满足欧盟(EU)2016/425个人防护设备指令(PPE)的要求。主流的防护口罩为FFP2/FFP3两类。
认证流程:1. 产品的型式试验报告;2. 技术文件评审;3. 工厂质量体系审查;4. 颁发CE证书;5. 产品出口。
注意:必须选择有PPE发证能力的发证机构申请,发证机构通过评审EN149报告后颁发CE-PPE证书。
NO.2
欧盟医用口罩(医疗器械)
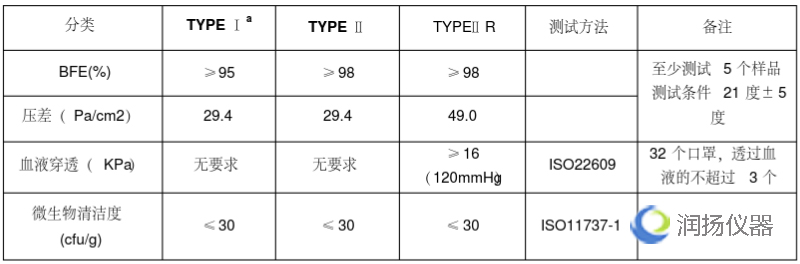
医用口罩的欧洲标准是EN14683,按照标准将医用口罩分为TYPE Ia/TYPE II/TYPE IIR三个类别。Type Ia用于流行病期间的患者和其它人群,Type II和Type IIR用于医护人员。需要满足欧盟(EU)2017/745(新版医疗器械MDR)的要求。口罩在欧盟属于I类器械,但是分为I类非无菌和无菌两种。
1.非无菌口罩(现阶段只有这种可行)
1)编制技术文件
2)提供测试报告(例如熔喷布性能测试报告和无纺布的生物学报告)
3)提供符合性声明
4)指定欧盟授权代表完成欧洲注册
时间估计:2-3个月
2.无菌口罩(现阶段新版MDR实施难度很大)
1)灭菌确认
2)ISO13485体系认证
3)编制技术文件
4)提供测试报告(生物学、性能、无菌等测试报告)
5)公告机构审核(目前几乎没有公告机构愿意接单)
6)获得CE证书
7)指定欧盟授权代表完成欧洲注册
时间估计:1-2年,因此今年几乎是不可能了!
检测标准
1)生物学评价:ISO10993-1,-5,-10(常规三项)
2)细菌过滤效率:EN 14683:2019附录B
3)呼吸阻抗:EN 14683:2019的附录C
4)防溅阻力:ISO 22609:2004
5)生物负载:EN ISO 11737-1:2018、EN 14683:2019附录D(同一批次检测数量不少于5个)
NO.3
美国FDA注册医用口罩
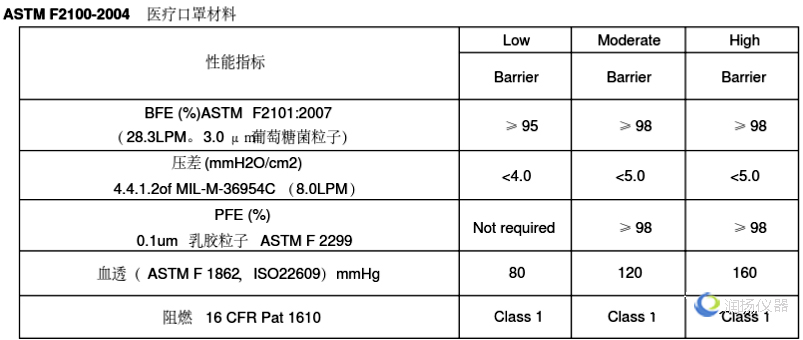
常见的医用口罩在美国FDA属于II类医疗器械,产品代码为FXX,规则号878.4040。除此之外还有OXZ儿科口罩和OUK带抗菌/抗病毒介质的外科口罩。一般来说选择FXX类型的口罩。
510k申请流程:1. 进行产品测试(性能测试、生物学测试);2. 准备510k技术文件,提交FDA审评;3. 获得FDA的510k批准信;4. 完成工厂注册和器械列名。
时间估计:6-10个月注意:如已从官方途径获得N95认证并通过生物学、阻燃和血液穿透测试可豁免510k
口罩检测必须满足ASTM的标准,如下:
NO.4
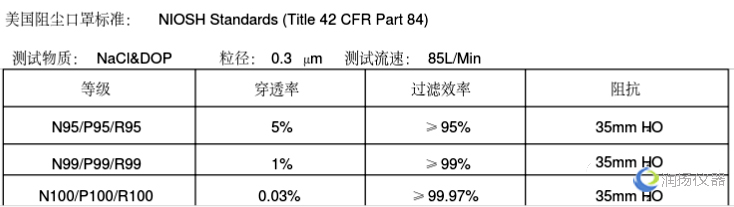
美国NIOSH认证防护口罩
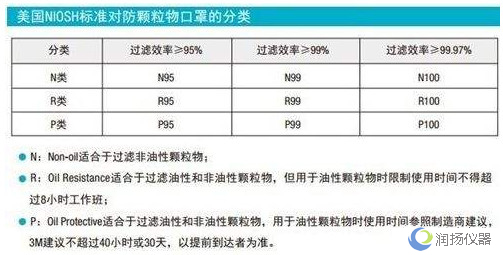
防护口罩需要获得NIOSH(美国国家职业安全卫生研究所)认证。按照过滤效率个人防护口罩可分成N95、N99、N100、R95、R99、R100、P95、P99、P100共9个类别。
按过滤网材质的蕞低过滤效率,可将口罩分为三种等级:N ,R ,P
N类的口罩只能过滤非油性颗粒物,比如:粉尘、酸雾、漆雾、微生物等。空气污染中的悬浮微粒,也多是非油性的。
R类的口罩只适合过滤油性颗粒物及非油性颗粒物,但用于油性颗粒物时限制使用时间不得超过8小时。
P类的口罩则既可过滤非油性颗粒物,又可过滤油性颗粒物。油性颗粒物比如:油烟、油雾等。
NIOSH认证系列口罩需符合42 CFR Part 84的要求,测试指标包括呼气阻力测试(Exhalation Resistance Test)、呼气阀泄漏测试(Exhalation Valve Leakage Test)、吸气阻力测试(Inhalation Resistance Test)、过滤效率测试(Sodium Chloride Test)等。
认证的申请需按照NIOSH的指南实施,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包括质量体系资料)至NIOSH进行文件审核,只有文件审核和产品测试都通过,NIOSH才会核发认证。具体的认证则由NIOSH下属的NPPTL 实验室操作。
时间估计:2-3个月